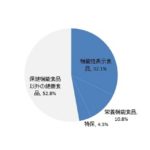
この半月ほどで、紅麹問題を受けた機能性表示食品制度の改正に関する告示や通知などが一気に示された。3 月22 日の小林製薬の発表から、「機能性表示食品を巡る検討会」「紅麹関連製品への対応に関する関係閣僚会合」「消費者委員会での審議」「パブリックコメント」などを経て固まった、改正機能性表示制度が始動する。
消費者庁は8 月23 日、「食品表示基準」の一部を改正する内閣府令を公布。機能性表示食品について、健康被害情報を得た場合、速やかに都道府県知事等に提供するとともに、消費者庁長官に提供することを規定、9 月1 日に施行した。このほか、サプリ剤型のGMP 要件化、「機能性表示食品」の文字を枠で囲み上部に表示するなど表示の見直しについて9 月1 日に施行、2年間の経過措置期間を設けた。また届出者は1 年ごとに、定められた事項を順守しているか自己評価を行い、消費者庁に報告する規定を導入。来年4 月1 日に施行する。さらに、専門家に意見を聴き新規成分の慎重な確認を行う“120 日ルール” を新たに導入。「PRISMA2020 年版」に合わせて、来年4 月1 日に施行となる。
厚生労働省は8 月23 日、「食品衛生法施行規則」の一部を改正する省令を公布、9 月1 日に施行した。機能性表示食品の届出者、特保の許可取得者に対し、「健康被害の発生及び拡大のおそれがある旨の情報を得た場合」に、当該情報を都道府県知事等に速やかに提供することを定めた。医師が診断した症例で、因果関係が不明なものも情報提供の対象となる。概ね30 日以内の間に、同じ所見の症例が2 例発生した場合に報告義務が生じる。重篤事例については1 例でも報告する。提供期限は、健康被害を診断した医療機関名を「知った日」から15 日以内。省令公布と同時に、留意事項を盛り込んだ「機能性表示食品等に係る健康被害の情報提供について」を都道府県等に通知した。
8 月23 日の公布等から1 週間後の8 月30 日、関連する告示や通知等が発出された。消費者庁は、サプリ形状を対象としたGMPの基準を告示。また、従来の届出ガイドラインをもとに、「機能性表示食品の届出等に関するマニュアル」を制定した。厚労省は、健康被害の情報提供に関するQ&Aをまとめ、公表した。(4面「速報スペシャル」で各種の発表を一覧に)